1. Khái quát về dược phẩm phóng thích biến đổi (modified release drug dosage forms)
Hiện nay thị trường dược phẩm đang phát triển rất mạnh mẽ, phong phú, chẳng những về số lượng dược chất mà cả về loại dược phẩm. Động lực tìm kiếm và phát triển dược phẩm mới luôn được duy trì vì tác nhân gây bệnh có xu hướng biến đổi, thay đổi và gia tăng liên tục trong quá trình phát triển của xã hội loài người theo hướng công nghiệp hóa, do tuổi thọ tăng cao, do môi trường ô nhiễm,... Ngoài ra, nhờ sự phát triển không ngừng của khoa học, kỹ thuật và công nghệ, trực tiếp nhất là sự phát triển của y sinh học, dược học, sinh dược học bản chất của các quá trình sinh học, bệnh học, các yếu tố gây bệnh, giải pháp điều trị được nhận thức sâu sắc và chính xác hơn, do đó các can thiệp y tế nói chung và sử dụng thuốc nói riêng trong điều trị ngày càng được mở rộng, được yêu cầu cao hơn và có hiệu quả hơn.
Các bối cảnh và điều kiện đó đã thúc đẩy sự phát triển thuốc theo 2 xu hướng: (1) tìm thuốc mới cho bệnh mới, tìm thuốc mới có cơ chế hoặc đích tác động mới; (2) tìm giải pháp cải thiện, nâng cao hiệu quả điều trị, giảm tác dụng phụ, tạo thuận lợi cho bệnh nhân bằng cách phát triển dược phẩm mới với dược chất đã và đang lưu hành.
Xu hướng phát triển dược phẩm mới với dược chất đã và đang lưu hành có tính thực tiễn và khả thi cao đã góp phần rất lớn cho sự phát triển của thị trường. Theo xu hướng này, trong những năm qua, thị trường đã dần dần phát triển và phổ biến các hệ thống mang thuốc phóng thích biến đổi, đó là dạng thuốc (dosage form) hoặc hệ thống mang thuốc (drug delivery system) được bào chế bằng cách dùng các loại tá dược đặc biệt, các hình thức cấu trúc, các kỹ thuật thiết kế hoặc sử dụng các tác nhân định hướng,.. nhằm tạo các tính năng đặc biệt cho dược phẩm như làm thay đổi và/hoặc kiểm soát tốc độ giải phóng dược chất tạo tác dụng kéo dài (TDKD); làm thay đổi vị trí giải phóng dược chất như giữ dược phẩm trong dạ dày, chỉ phóng thích tại ruột, tại đại tràng; hoặc giải phóng dược chất tại mục tiêu tác động như tại khối u, tại mô đích làm tăng hiệu quả và giảm tác dụng phụ trong điều trị,... Việc làm thay đổi, kiểm soát tốc độ phóng thích và vị trí phóng thích dược chất dẫn đến thay đổi đặc điểm dược động, dược lực, an toàn và hiệu quả điều trị của thuốc, làm cho dạng thuốc mới, thuốc phóng thích biến đổi khác biệt so với dạng thuốc thông thường hay dạng bào chế quy ước được phát triển đầu tiên dựa trên đặc tính nguyên thủy của dược chất. Điều này dẫn đến các quy định về đánh giá, kiểm soát chất lượng dược phẩm mới được áp dụng theo mô hình thuốc mới, khác biệt so với thuốc generic.
Các dạng phóng thích biến đổi đường uống hay gặp gồm:
- Hệ thống phóng thích kéo dài (PTKD) với 03 mô hình phóng thích: (1) phóng thích có kiểm soát (controlled release), (2) phóng thích kéo dài (sustained release), phóng thích chậm, kéo dài (prolonged release);
- Dạng phóng thích trễ (delayed release) với các loại: (1) tan trong ruột (enteric dissolution); dạng phóng thích trễ và lập lại (repeated release), dạng phóng thích trễ theo nhiều pha (multiphasic release), dạng phóng thích trễ theo nhịp (pulsatile release), dạng phóng thích tại mục tiêu trong đường tiêu hóa (targeted release),...
Tùy thuộc vào yêu cầu của điều trị, đặc tính của dược chất và các yếu tố ảnh hưởng đến sinh dược của dạng thuốc có thể ứng dụng các tá dược đặc biệt, các mô hình thiết kế, các kỹ thuật và công nghệ khác nhau để bào chế các hệ thống mang thuốc phóng thích biến đổi.
2. Các dược phẩm phóng thích biến đổi tạo tác dụng kéo dài
2.1. Cơ sở khoa học thực tiễn yêu cầu sử dụng thuốc TDKD
Để đạt hiệu quả và không làm tăng tác dụng không mong muốn khi dùng thuốc, yêu cầu cần là nồng độ dược chất phải đạt được ngưỡng trị liệu nhanh và duy trì nồng độ trong khoảng trị liệu suốt thời gian điều trị. Đối với thuốc phóng thích nhanh, sự phóng thích và hấp thu thường theo tốc độ bậc I, do đó dễ đạt được ngưỡng trị liệu trong thời gian ngắn, tuy nhiên dược chất thường có thời gian bán thải ngắn, dẫn đến phải sử dụng thuốc nhiều lần để duy trì nồng độ trị liệu suốt thời gian điều trị. Cách sử dụng thuốc đa liều, nhiều lần dẫn đến sự dao động nồng độ trong huyết tương, có nguy cơ gia tăng tác dụng không mong muốn, gây bất tiện cho người sử dụng, dễ có nguy cơ không đảm bảo tuân trị từ bệnh nhân và nguy cơ cho liều không phù hợp từ bác sĩ,..
Thuốc PTKD thường được thiết kế nhằm đảm bảo đạt nồng độ trị liệu nhanh và duy trì nồng độ thuốc ở khoảng trị liệu trong thời gian dài hơn so với thuốc quy ước, do đó giúp đạt ngưỡng có tác động nhanh, duy trì nồng độ trong máu hằng định, ít dao động, trong thời gian dài, giúp giảm số lần dùng thuốc, kéo dài thời gian trị liệu có thể làm tăng hiệu quả điều trị, giảm tác dụng không mong muốn, độc tính, có thể kiểm soát tốt tình trạng bệnh, ngay cả lúc ngủ. Thuốc PTKD giúp khắc phục nhược điểm và những nguy cơ khi dùng thuốc quy ước, rất phù hợp trong điều trị bệnh mạn tính, cần sử dụng thuốc liên tục, tạo thuận lợi cho người bệnh và cả nhân viên y tế.
Có thể nói, khi bào chế hệ thống PTKD, tạo TDKD, chúng ta đã chuyển kiểm soát sự tuân trị từ người bệnh và sự phù hợp kê đơn từ bác sĩ sang nhà khoa học bào chế và thiết kế dạng thuốc.
2.2. Các nguyên tắc và mô hình bào chế thuốc phóng thích kéo dài
Cần tuân thủ các nguyên tắc và xem xét các yếu tố sau khi bào chế thuốc PTKD:
1. Thiết kế chế phẩm sao cho tốc độ phóng thích dược chất từ dạng thuốc là chậm nhất và quyết định tốc độ hấp thu dược chất. Từ đó, quá trình đưa thuốc vào cơ thể hoặc đến nơi tác động chỉ phụ thuộc vào tốc độ phóng thích dược chất, không bị ảnh hưởng bởi tốc độ hấp thu. Để đạt mục tiêu này, thường dùng các tá dược kiểm soát phóng thích, các kiểu cấu trúc, các tác nhân gây ảnh hưởng để kiểm soát sự hòa tan và tốc độ phóng thích dược chất theo các mô hình như làm chậm, trễ, làm gián đoạn,… một cách phù hợp.
2. Xem xét yêu cầu trị liệu, các đặc tính lý hóa của dược chất và đặc tính sinh dược của dạng thuốc và đường dùng để lựa chọn thành phần và mô hình giải phóng thuốc phù hợp.
3. Lựa chọn loại tá dược đặc biệt, cơ chế kiểm soát phóng thích, cấu trúc và thiết kế của sản phẩm.
4. Kiểm soát đặc tính phóng thích kéo dài và tác dụng kéo dài, chất lượng và sự ổn định của dược phẩm được sản xuất như mong muốn.
Mô hình lý tưởng trong thiết kế, bào chế hệ thống PTKD là dược phẩm được cấu thành từ 2 phần để riêng hoặc phối hợp chung:
- Phần liều tải hay liều khởi đầu (Di): Mục đích tạo nồng độ tải nhanh (loading dose), đạt ngưỡng trị liệu nhanh. Yêu cầu đặc tính của Di: phóng thích dược chất nhanh thường theo tốc độ bậc 1, cho tác dụng nhanh như thuốc quy ước.
- Phần liều kéo dài hay liều duy trì (Dm): Mục đích cung cấp dược chất để duy trì nồng độ trị liệu, kéo dài suốt thời gian mong muốn. Yêu cầu phóng thích chậm, tốc độ lý tưởng là bậc 0 sao cho lượng thuốc hấp thu vào tuần hoàn bằng với lượng thuốc đưa ra khỏi tuần hoàn, giúp duy trì nồng độ hằng định trong máu.
- Từ đó, tổng cộng lượng thuốc trong chế phẩm (w), gồm:
W = Di + Dm
Lượng dược chất của Di có thể linh động thay đổi tùy cơ chế phóng thích và thời điểm bắt đầu phóng thích dược chất từ phần liều duy trì Dm.
Thực tế, lượng dược chất trong dạng phóng thích kéo dài thường cao hơn dạng quy ước khi chỉ định cùng liều, lượng cao này nhằm cung cấp dược chất cho kéo dài thời gian tác dụng.
3.Ứng dụng công nghệ pellet trong bào chế thuốc phóng thích biến đổi tạo tác dụng kéo dài đường uống
3.1. Ưu nhược điểm của dạng bào chế pellet
Pellet là những hạt nhỏ, có hình cầu hoặc gần như cầu, kích thước từ 0,25 đến 1,5 mm, (trong đó micropellet là nhóm có kích thước trung bình từ 0, 4 - 0,7 mm). Pellet được bào chế bằng cách phối hợp dược chất rắn với các tá dược dính thích hợp và thường được bao màng bảo vệ, màng kháng dịch vị hay bao màng kiểm soát giải phóng hoạt chất.
Pellet là bán thành phẩm, thường được đóng trong những nang cứng (spansule hay MUPS - Multiple unit pellet system); các pellet, đặc biệt các micropellet dễ dàng được bào chế thành viên nén (viên MUPS), viên phân tán trong miệng, bào chế cốm pha hỗn dịch. Các dược phẩm như spansule chứa pellet hình cầu có màu sắc cảm quan rất hấp dẫn.
Với đặc điểm từng đơn vị độc lập, có hình cầu, kích thước nhỏ và thường có màng bao, dạng pellet/micropellet có nhiều ưu điểm được ứng dụng linh hoạt trong bào chế và sử dụng thuốc:
- Có thể phối hợp các thành phần dược chất tương kỵ với nhau trong cùng dạng thuốc hoặc tăng cường bảo vệ và ổn định chống tác động bất lợi của môi trường bên ngoài như hơi ẩm, oxy trong không khí,... nhờ màng bao cách ly hoặc màng bao bảo vệ.
- Dễ kiểm soát và làm thay đổi sự giải phóng dược chất bằng cách sử dụng lớp bao, màng bao có tính năng khác nhau: màng kiểm soát sự phóng thích bằng quá trình khuếch tán, màng bao tan trong ruột tạo phóng thích trễ, các màng bao tan ở các thời điểm khác nhau làm phóng thích kéo dài kiểu lập lại hoặc theo nhiều pha, màng bao tan trong điều kiện môi trường khác nhau như pH, men làm phóng thích tại đích nơi có điều kiện phù hợp,... từ đó có thể bào chế các dược phẩm phóng thích biến đổi tan trong ruột, phóng thích kéo dài theo mô hình lập lại, mô hình nhiều pha, phóng thích tại đích tác động,…
- Về sinh dược: Sau khi MUPS rã, pellet/micropellet có kích thước nhỏ dễ dàng đi qua môn vị dạ dày làm cho thuốc bị đẩy khỏi dạ dày một cách từ từ, đều đặn và giảm được các hiện tượng dồn liều, hoặc kích ứng cục bộ, gây tổn thương niêm mạc dạ dày, khắc phục được nhược điểm của viên nén và viên nang thường quy. Hơn nữa pellet có diện tích bề mặt tiếp xúc lớn nên sự hòa tan, sự phóng thích dược chất rất ổn định, từ đó có sinh khả dụng của thuốc ổn định hơn so với viên nén.
- Về sử dụng: Dược phẩm từ pellet là hệ đa tiểu phân nên dễ tránh được hiện tượng bùng liều và một số nguy cơ khác do khuyết tật có thể có của màng bao gây ra.
- Về bào chế: Trong kỹ thuật bao màng, pellet có hình cầu hoặc gần cầu thuận lợi hơn rất nhiều, diện tích bề mặt hình cầu nhỏ nhất với đường kính xác định, không góc cạnh làm ảnh hưởng đến sự di chuyển của tiểu phân trong buồng bao, tiểu phân được tiếp xúc đồng đều với dịch phun, tạo điều kiện hình thành màng bao đồng nhất, hầu như ít hoặc không có khuyết tật. Trong dập viên bào chế MUPS sự trơn chảy tốt của pellet cho phép thu dễ dàng viên nén có độ đồng nhất về khối lượng hoặc hàm lượng giữa các đơn vị liều trong cùng lô hoặc mẻ.
Tuy nhiên, dạng pellet cũng có những hạn chế:
- Khả năng tải thuốc thấp hơn do nhu cầu tỉ lệ tá dược nhiều hơn (ví dụ nhân đường)
- Quá trình sản xuất trải qua nhiều công đoạn, phức tạp, với các biến số cần kiểm soát gây khó đảm bảo yêu cầu đồng nhất và lặp lại của sản phẩm.
- Mức độ đồng nhất về tỷ trọng và kích thước ảnh hưởng rất lớn đến độ đồng nhất về khối lượng và hàm lượng của các sản phẩm cuối cùng (viên nang, viên nén, hoặc gói), đặc biệt với những dược chất có hàm lượng nhỏ.
- Yêu cầu sử dụng thiết bị chuyên dụng như hệ thống thiết bị đùn - tạo cầu và đặc biệt yêu cầu thiết bị tạo hạt tầng sôi khi bào chế micropellet. Việc bào chế micropellet có kích thước nhỏ nên bị thổi mạnh hơn, kéo dài thời gian trong thiết bị, giảm hiệu suất bao, đồng thời dễ thấm ướt dịch phun, gây nguy cơ dính đôi, dính ba rất cao, do đó cần giám sát chặt chẽ các thông số về công thức và quy trình bào chế, người vận hành thiết bị được đào tạo phù hợp, có kiến thức và kinh nghiệm thực tế.
3.2. Các mô hình thiết kế viên PTKD ứng dụng công nghệ pellet
Có thể linh hoạt lựa chọn thiết kế sản phẩm với các mô hình:
- Mô hình mỗi pellet là đơn vị phóng thích kéo dài hoàn chỉnh: từng pellet có phần phóng thích nhanh và phần phóng thích chậm đáp ứng yêu cầu kéo dài thời gian trị liệu. Có thể khởi đầu từ nhân trơ, thường sử dụng nhân đường, hoặc nhân thuốc là tiểu phân rắn, tinh thể, hoặc hỗn hợp thuốc - tá dược. Lớp kiểm soát thường là các polime được lựa chọn tùy tính năng mong muốn của pellet và dược phẩm và cơ chế kiểm soát sự phóng thích như dùng polime tan trong ruột non, polime làm phóng thích chậm theo cơ chế khuếch tán, bào mòn, polime hòa tan trễ theo từng thời điểm, polime tan trong điều kiện sinh lý, môi trường, yếu tố đặc biệt,… Phương pháp bào chế là phương pháp bồi dần trong thiết bị tầng sôi. Cấu trúc pellet có thể như sau:
(1) Cấu tạo từ nhân trơ, phần phóng thích chậm (Dm), màng kiểm soát và phần phóng thích nhanh (Di)
(2) Cấu tạo từ nhân là thuốc (hỗn hợp thuốc tá dược, tinh thể, tiểu phân rắn) phóng thích chậm, màng kiểm soát và phần phóng thích nhanh.

(1)

(2)
- Mô hình các pellet có tính năng khác nhau, được phối hợp để tạo hiệu quả phóng thích kéo dài và tác dụng kéo dài hoàn chỉnh.
(3) Spansule TDKD phối hợp 2 loại pellet: loại pellet phóng thích nhanh và loại pellet phóng thích chậm, trễ hoặc từ từ.
(4) Spansule TDKD phối hợp 3 loại pellet: loại pellet phóng thích nhanh, loại pellet phóng thích chậm ở thời điểm 1, loại pellet phóng thích chậm ở thời điểm 2.
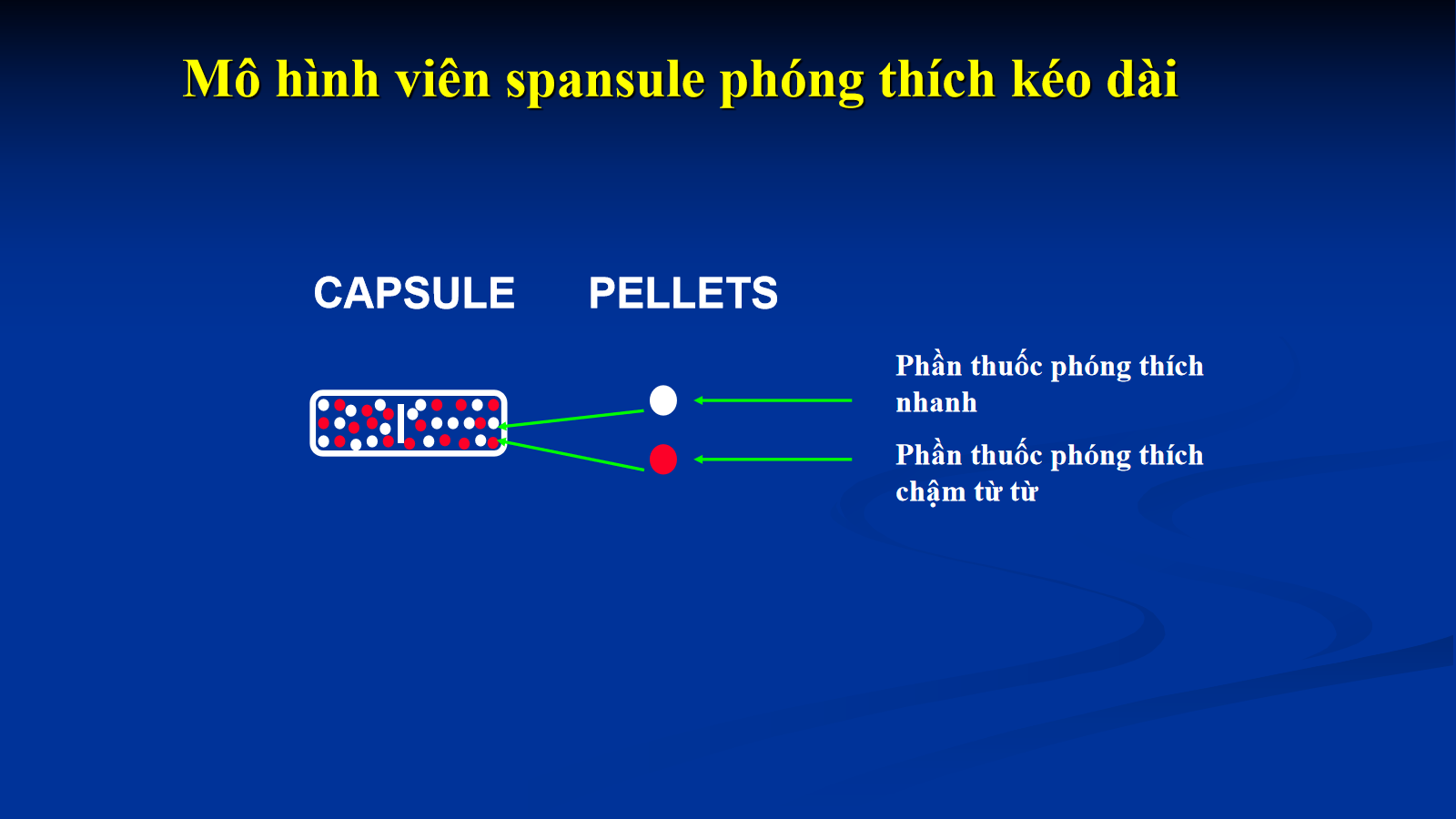
(3)
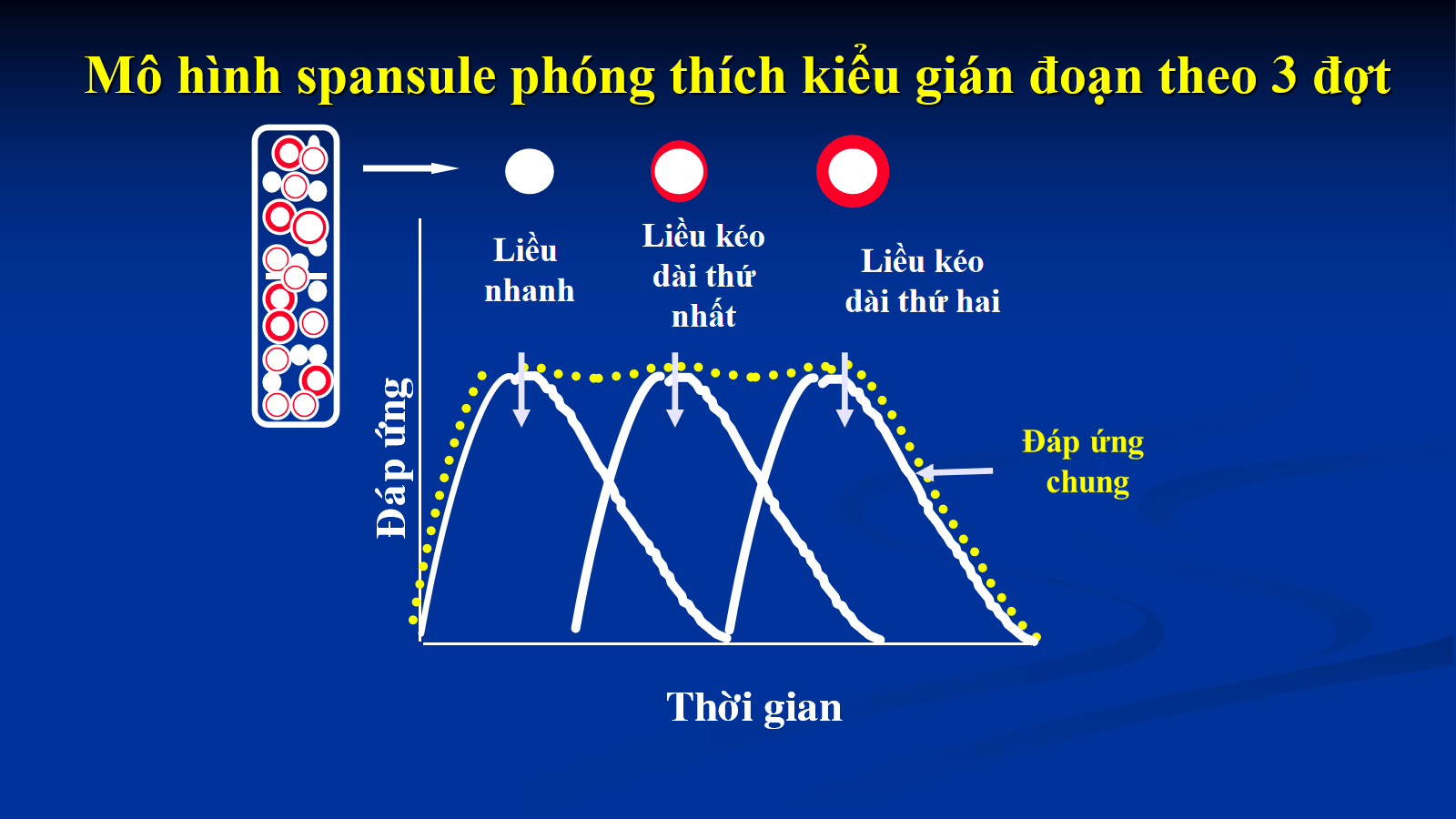
(4)
GSTS. Lê Quan Nghiệm
Chủ tịch hội đồng khoa học công nghệ