1. Tổng quan về hệ thống mang thuốc đến mục tiêu và thuốc điều trị đích
Nghiên cứu ở mức phân tử cho thấy, trong sử dụng thuốc để đạt hiệu quả trị liệu, dược chất phải được đưa đến nơi tác động, kết hợp với thụ thể dược lý và duy trì được nồng độ trong khoảng trị liệu tại nơi tác động suốt liệu trình. Thực tiễn, trong hầu hết trường hợp trị liệu yêu cầu này khó đạt vì dưới tác động của cơ thể, dược chất được phân bố theo cơ chế khuếch tán thụ động rộng khắp cơ thể, thiếu định hướng chọn lọc và tập trung chuyên biệt đến nơi tác động, do đó để đạt ngưỡng nồng độ trị liệu thường phải sử dụng liều cao; sự phân bố rộng cũng tạo điều kiện cho dược chất có thể tương tác với các receptor khác ngoài đích dược lý và đích trị liệu dẫn đến tác dụng phụ không mong muốn và độc tính, vấn đề này có thể rất nghiêm trọng, đặc biệt đối với các dược chất có hoạt lực mạnh, có khả năng tương tác với nhiều loại thụ thể ở nhiều vị trí khác nhau, do đó gần như là quy luật, sử dụng thuốc song song với hiệu quả luôn luôn kèm theo độc tính và tiêu chí chọn thuốc luôn phải dựa trên mối tương quan “hiệu quả - độc tính”.
Ngoài đặc điểm phân bố không có tính chọn lọc và chuyên biệt, thể hiện bởi thể tích phân bố lớn, ở dạng bào chế thông thường dược chất tự do sau khi được hấp thu vào tuần hoàn có thể bị phơi bày và tác động của các yếu tố như pH, enzym trong môi trường sinh học gây phân hủy, chuyển hóa, hoặc bị ly trích bởi các cơ quan như mô, gan, phổi… làm nồng độ, sự nguyên vẹn và hoạt tính bị ảnh hưởng; ngoài ra có những bệnh lý hoặc khu vực như cơ quan, mô, bộ phận có những cấu trúc đặc biệt, trở thành rào cản sinh lý, bệnh lý, làm dược chất khó tiếp cận với tác nhân gây bệnh ở bên trong như trường hợp điều trị bệnh viêm khớp, bệnh ở hệ thần kinh não tủy, một số bệnh nhiễm do ký sinh trùng…
Những tình huống này đặt ra vấn đề đối với các nhà khoa học bào chế là có thể kiểm soát, điều chỉnh để đưa thuốc chọn lọc, chuyên biệt đến mục tiêu tác động, giảm phân bố dược chất đến nơi khác hoặc tìm kiếm phân tử thuốc chỉ có hoạt lực tại mục tiêu, không tạo tác động ngoài mục tiêu để đảm bảo hiệu quả trị liệu, không tạo tác dụng phụ không mong muốn hoặc làm tăng độc tính của thuốc.
Với sự nổ lực và phát triển không ngừng, trong những năm qua các hệ thống mang thuốc đến mục tiêu đã được nghiên cứu phát triển và đưa vào sử dụng trị liệu ngày càng nhiều, mở ra xu thế đầy tiềm năng trong phát triển dược phẩm mới có hiệu quả và giảm tác dụng không mong muốn từ dược chất cổ điển, song song đó là các nghiên cứu tìm kiếm, khám phá các tác nhân trị liệu mới theo cơ chế tác động chuyên biệt, tác động chọn lọc với đích cụ thể, hình thành thế hệ thuốc mới - thuốc điều trị đích - tạo hiệu quả trị liệu giống như hình tượng kiểu viên đạn thần kỳ (magic bullet).
1.1. Khái niệm hệ thống mang thuốc đến mục tiêu (Target - oriented drug delivery system - TDD)
TDD là hệ thống dẫn truyền có khả năng mang “phần lớn” dược chất tới đích tác động một cách chọn lọc nhằm đạt hiệu quả trị liệu tối đa, giảm tác dụng không mong muốn và độc tính, ngăn ngừa sự phân hủy, sự bất hoạt của dược chất trong quá trình vận chuyển, hoặc vượt qua các rào cản tự nhiên của cơ thể để đến nơi trị liệu.
TDD được xếp vào nhóm dược phẩm phóng thích biến đổi (modified release), trong đó vị trí phóng thích hoặc cả vị trí và tốc độ phóng thích được kiểm soát; do đó TDD có thể là loại thuốc phóng thích nhanh hoặc thuốc phóng thích chậm, kéo dài.
1.2. Khái niệm thuốc điều trị đích (Targeted therapy drugs)
Thuốc điều trị đích là thuốc tác động đến các đối tượng chuyên biệt, đặc trưng có liên quan đến cơ chế, quá trình phát sinh, phát triển đặc thù của bệnh lý như tác động đến các gen mã hóa các protein, chất sinh học trung gian, các men xúc tác chuyển hóa và các tác nhân truyền tín hiệu tế bào,... Tác động của thuốc chọn lọc và chuyên biệt với thụ thể của mục tiêu, do đó thuốc chỉ có tác động khi có hiện diện của phân tử mục tiêu, tạo hiệu quả điều trị mà không gây tác động, ảnh hưởng đến đối tượng sinh học khác, ít tạo tác dụng không mong muốn và độc tính.
Ví dụ điều trị đích và thuốc điều trị đích trong bệnh ung thư: Trong tế bào có hệ thống gồm một chuỗi phản ứng nhiều phân tử hoạt động theo mô hình dây truyền. Khi có một mắt xích nào đó trong dây truyền này bị kích thích, hoặc mất cơ chế điều hòa, cơ chế kiểm soát, hệ thống sẽ hoạt động rất mạnh mẽ kích thích tế bào phân chia không ngừng, tế bào ung thư hình thành và tiến triển, tạo khối u và di căn,... Điều trị đích là chiến lược trị liệu kháng lại các phân tử đặc hiệu cụ thể có liên quan đến hệ thống dẫn truyền tín hiệu dẫn đến sự phân chia, tiến triển và di căn ung thư.
Những biến đổi chính ở mức tế bào và phân tử của bệnh ung thư: (1) tế bào tự phát tín hiệu tăng trưởng, (2) tế bào trơ với tín hiệu chống tăng trưởng, (3) kích thích tăng sinh mạch, (4) xâm lấn vào mô và di căn, (5) thoát hiện tượng chết theo chương trình, (6) khả năng phân bào không giới hạn.
Các nhóm thuốc điều trị liên quan đến quá trình phát sinh, phát triển ung thư:
- Hormone: làm chậm hay dừng hẳn sự tăng trưởng khối u nhạy cảm với hormone, áp dụng trong điều trị nội tiết ung thư vú, ung thư tuyến tiền liệt
- Chất ức chế truyền tín hiệu (signal transduction inhibitors): ngăn chặn sự hoạt động của các phân tử tham gia vào quá trình truyền tín hiệu liên quan đến tăng sinh tế bào ung thư
- Các chất điều biến sự biểu hiện gen (gene expression modulators): làm biến đổi chức năng của các protein giữ vai trò quan trọng trong việc kiểm soát biểu hiện gen
- Các chất cảm ứng sự chết theo chương trình (apoptosis inducers): làm cho các tế bào ung thư phải trải qua quá trình chết theo chương trình.
- Các chất ức chế tạo mạch (angiogenesis inhibitors) ngăn chặn sự tăng trưởng các mạch máu mới cần cho phát triển khối u.
- Trị liệu miễn dịch (immunotherapies) kích thích hệ miễn dịch của cơ thể để tiêu diệt các tế bào ung thư.
- Các kháng thể đơn dòng: tiêu diệt các tế bào ung thư một cách đặc hiệu
Hiện nay, các thuốc điều trị đích chủ yếu thuộc 2 nhóm: Nhóm các kháng thể đơn dòng “-mab”(monoclonal antibodies) nhắm vào các đích đặc hiệu bên ngoài bề mặt tế bào, nhóm các phân tử nhỏ “-ib” (small molecules) có thể xâm nhập vào tế bào, nhắm vào các đích bên trong tế bào.
Ví dụ Bevacizumab thuộc nhóm “kháng sinh mạch”, là một loại kháng thể đơn dòng gắn và làm bất hoạt VEGF (Vascular Endothelial Growth Factor) được dùng trong điều trị ung thư đại trực tràng, phổi và vú. Các tế bào ung thư để tồn tại và tiến triển, cần chất dinh dưỡng và oxy cung cấp từ các mạch máu, hơn nữa, mạch máu cũng là con đường di căn ung thư quan trọng. Để có nhiều mạch máu, tế bào ung thư tiết ra các chất kích thích sinh mạch có tên là VEGF. VEGF sẽ tìm đến các thụ thể của chúng là VEGFR (Vascular Endothelial Growth Factor Receptor) ở tế bào nội mạc mạch máu để kích thích quá trình sinh mạch. Việc loại bỏ VEGF hoặc ngăn chặn dẫn truyền tín hiệu tại thụ thể VEGFR sẽ làm ngưng quá trình sinh mạch.
1.3. Tầm quan trọng của hệ thống mang thuốc đến mục tiêu và thuốc điều trị đích trong trị liệu bệnh ung thư
Điều trị đích được xem là phương thức điều trị lý tưởng; hệ thống mang thuốc đến đích và thuốc điều trị đích là dược phẩm thế hệ mới được phát triển với tốc độ khá nhanh trong những năm gần đây nhờ các tiến bộ và thành tựu to lớn trong lĩnh vực sinh học, bệnh học, sinh học phân tử, công nghệ sinh học, khoa học về omics (genomics, proteinomics, metalonomics,...). Các tiến bộ và thành tựu này cho phép xác định được những markers sinh học, những sự biến đổi bệnh lý so với sinh lý ở mức phân tử, những đích cụ thể liên quan đến bệnh lý và phương thức trị liệu.
Thuốc điều trị đích và hệ thống mang thuốc đến mục tiêu sử dụng trong điều trị bệnh ung thư rất được quan tâm nghiên cứu phát triển vì các hóa chất truyền thống điều trị bệnh ung thư theo cơ chế độc với tế bào ung thư, lại tác động cả trên hoạt động của tế bào bình thường, dẫn đến độc tính rất cao.
2. Các phương thức và cơ chế mang thuốc đến mục tiêu
2.1. Phương thức tiền dược (prodrug) hoặc tiền dược kép (proprodrug)
Tiền dược và tiền dược kép là dạng không có hoạt tính sinh học, trong cơ thể phải trải qua một hoặc nhiều quá trình biến đổi thích hợp để tái tạo trở lại dược chất có hoạt tính như ban đầu. Tiền dược được sử dụng với nhiều mục đích trong đó có mục đích mang thuốc đến nơi tác động. Mô hình biến đổi có thể qua 2 lần, như sau:

Tiền dược có thể mang thuốc đến nơi tác động như sau:
(1) Tiền dược không có hoạt tính được phân bố khắp cơ thể, khi đến nơi tác động tiền dược được biến đổi tạo thành dược chất ban đầu có hoạt tính nhờ các tác nhân phù hợp tại nơi tác động.
(2) Tiền dược giúp mang thuốc đến khu vực đặc biệt như vận chuyển dược chất thân nước qua hàng rào sinh học thân dầu bằng cách biến đổi dược chất thân nước thành dạng tiền dược thân dầu, do đó dễ dàng được vận chuyển qua màng sinh học và được tiếp nhận vào khu vực mục tiêu, như vượt qua hàng rào thân lipid vào vùng não tũy, tại đây nhờ tác động của các tác nhân như pH, men chuyển hóa, tiền dược được biến đổi và tái tạo phân tử dược chất ban đầu tại nơi tác động và tạo ra hiệu quả điều trị.
Ví dụ trường hợp viên bao chứa capecitabine là tiền dược kép của dược chất fluorouracil (5FU) điều trị bệnh ung thư. Capecitabine không có tác dụng dược lý, sau khi uống nhanh chóng được hấp thu và phân bố toàn thân, capecitabine được chuyển hóa qua 3 bước, 2 sản phẩm trung gian ban đầu không có hoạt tính; ở bước thứ ba do xúc tác của enzym thymidine phosphorylase tạo thành 5FU có hoạt tính. Do nồng độ enzym thymidine phosphorylase ở tế bào ung thư cao hơn đáng kể so với ở tế bào khỏe mạnh nhờ đó phần lớn thuốc sẽ được chuyển hóa thành dạng có hoạt tính ngay tại tế bào ung thư và mô đích. Nghiên cứu trên bệnh nhân ung thư vú tiến triển cho thấy, nồng độ 5-FU tại mô ung thư cao hơn 2,5 lần so với mô bình thường và cao hơn 14 lần so với trong huyết tương sau khi uống capecitabine.
Dạng tiền dược kép đã giúp phần lớn 5 FU được tái tạo và tập trung ở mô ung thư tạo tác dụng, hạn chế phân bố 5 FU ở các mô lành, từ đó giảm độc tính và mở rộng được khoảng trị liệu tạo hiệu quả cao hơn (liều tối đa 5.600 mg/ngày, cao gấp đôi so với thuốc tiêm Fluorouracil có liều tối đa là 1000 mg/ngày).
Nguồn: -H. Ebi và các cộng sự. (2005), "Pharmacokinetic and pharmacodynamic comparison of fluoropyrimidine derivatives, capecitabine and 5'-deoxy-5- fluorouridine (5'-DFUR)", Cancer Chemother Pharmacol. 56(2), tr. 205-11.
-T. Ishikawa và các cộng sự. (1998), "Tumor selective delivery of 5- fluorouracil by capecitabine, a new oral fluoropyrimidine carbamate, in human cancer xenografts", Biochem Pharmacol. 55(7), tr. 1091-7.
-F.Hoffmann-La Roche Ltd. (2015), Full prescribing information for XELODA.
2.2. Phương thức hệ thống mang thuốc có cấu trúc tiểu phân nano
2.2.1. Cấu trúc và phân loại các tiểu phân nano
Dùng các hệ thống chuyên chở, dẫn truyền có khả năng mang dược chất đến đích một cách chọn lọc. Trong hệ thống mang sự phân bố thuốc trong cơ thể chỉ phụ thuộc tính chất của hệ thống mang hoặc chất mang (các polimer), không phụ thuộc vào tính chất của dược chất; do đó, có thể điều chỉnh, kiểm soát khả năng đến mục tiêu của hệ thống bằng cách chọn chất mang phù hợp hoặc thay đổi tính chất của chất mang để đạt mục tiêu đến đích một cách chủ động hoặc thụ động nhờ phản ứng của cơ thể.
Các hệ thống mang vi tiểu phân có kích thước nano và cấu trúc có thể sử dụng mang thuốc như sau: liposome, vi nhũ tương, tiểu phân nano lipid, niosome (micelle), vi nang, vi cầu,..
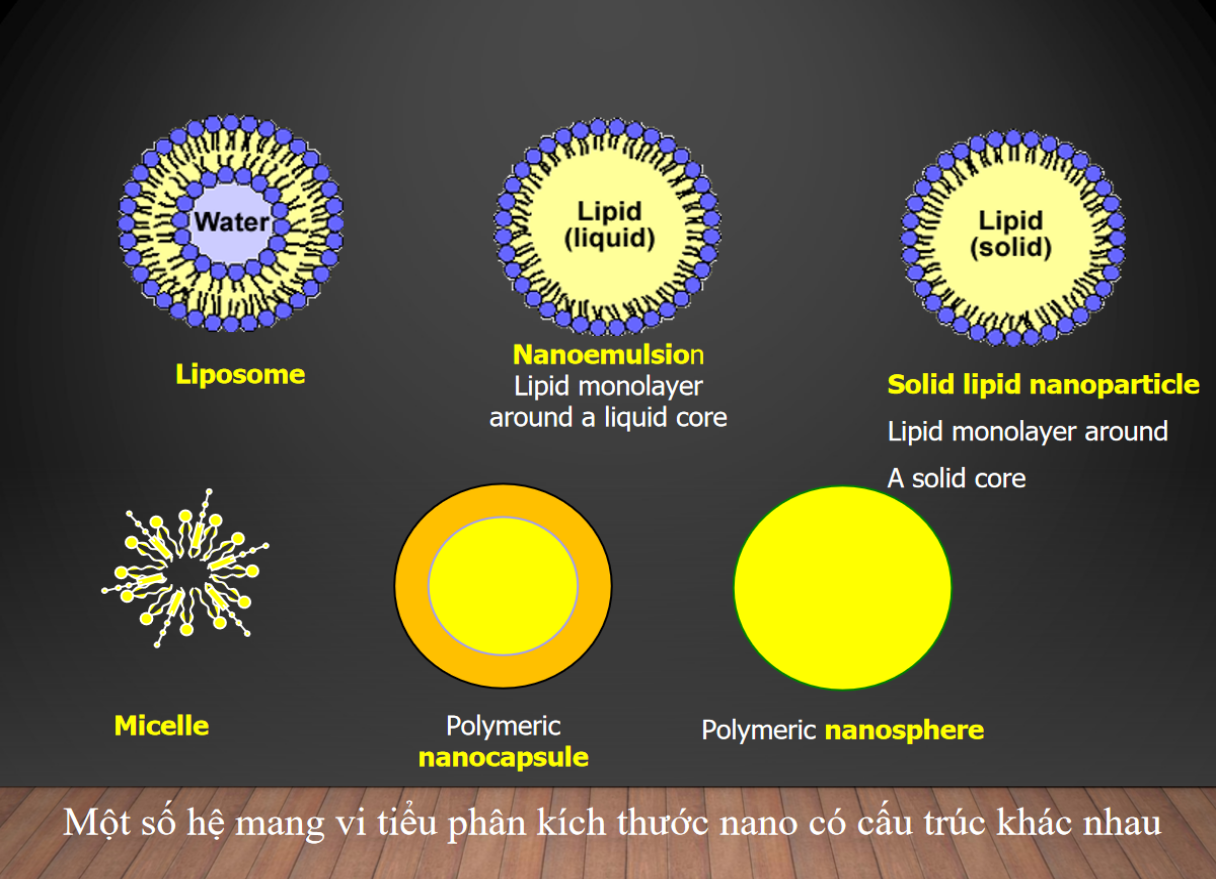
2.2.2. Cơ chế đưa thuốc đến mục tiêu theo cách thụ động
Hệ thống được đưa đến mục tiêu nhờ các phản ứng, điều kiện sinh lý tự nhiên của cơ thể như sự thực bào, sự giữ lại do kích thước lớn hơn lòng mạch, giữ lại do khác biệt về giải phẫu bệnh lý của mô/tế bào đích và phóng thích tại đích do tác nhân điều khiển từ bên ngoài,..
(1) Sự thực bào: các đại thực bào của hệ nội mạc võng mô (reticulo endothelial system- RES),gồm: toàn bộ bạch cầu mono, đại thực bào di động, đại thực bào mô cố định, và một vài tế bào nội mô chuyên biệt trong tủy xương, lách, và hạch lympho sẽ thực bào tiểu phân lạ, có kích thước. Do bị thực bào hệ thống mang thuốc là các tiểu phân lạ được đưa đến các cơ quan định vị của đại thực bào và phóng thích phần lớn dược chất tại nơi đó.
(2) Sự lọc và giữ lại do kích thước lớn hơn: các mao quản có đường kính nhỏ giữ lại tiểu phân có kích thước lớn hơn. Theo cơ chế này khi tiêm IV các tiểu phân có kích thước > 7 mcm, tiểu phân bị lọc bởi các mao quản nhỏ nhất của phổi có thể bị giữ lại ở phổi; tiêm động mạch mạc treo ruột, động mạch cửa, động mạch thận, tiểu phân bị giữ lại toàn bộ ở ruột, gan, thận tương ứng. Đối với cơ quan mang khối u, phương pháp này có thể định vị hệ thống trong tế bào ung thư của các cơ quan có khối u.
(3) Nhờ các đặc điểm khác biệt về giải phẫu bệnh lý của mô/tế bào đích, như:
Hiện tượng tăng tính thấm, tăng hiệu quả lưu giữ là đặc trưng của tế bào ung thư (hiệu ứng EPR ), hiện tượng tăng kích thước khe hở giữa các tế bào của mao mạch mới tăng sinh (trung bình100 - 800nm) so với khe hở của tế bào bình thường (trung bình 5 - 10 nm) dẫn đến không gian và áp suất thẩm thấu lớn hơn trong các mao mạch và mô ung thư. Do đó, bắt giữ hệ mang thuốc có kích thước lớn mức phù hợp.
(4) Dùng các tác nhân lý hóa đặc biệt như pH, nhiệt độ, từ trường,...để kích hoạt sự phóng thích thuốc tại nơi tác động. Ví dụ: hệ thống mang sử dụng vật liệu từ tính đã được ứng dụng để chuyển giao dược chất tại đích bằng từ trường ngoài. Hệ thống mang dược chất khi được phân bố đến bàng quang bị cảm ứng của từ trường áp đặt từ thiết bị bên ngoài làm phóng thích dược chất tự do trong bàng quang. Hệ thống được áp dụng thành công trong mang thuốc đến bàng quang và điều trị ung thư bàng quang.
2.2.3. Cơ chế đưa thuốc đến mục tiêu theo cách chủ động
Hệ thống tự định hướng đến mục tiêu nhờ được biến đổi đặc tính bề mặt tránh sự thực bào và kết hợp các chất mang có ái lực kết nối với mục tiêu như dùng các chất kết nối (ligand) chuyên biệt, liên kết tiểu phân với kháng thể đơn dòng, các ligand đặc biệt của tế bào, các glycoprotein, phospholipid, các immunoglobulin cơ thể, ..
Sự thay đổi các đặc tính bề mặt của tiểu phân để hạn chế tối đa hoặc tránh sự thực bào như dùng chất dính sinh học, chất diện hoạt không ion hóa để chúng không được nhận biết bởi hệ RES như là một chất lạ.
2.2.4. Các ví dụ về hệ mang thuốc cấu trúc liposome và cấu trúc tiểu phân nano
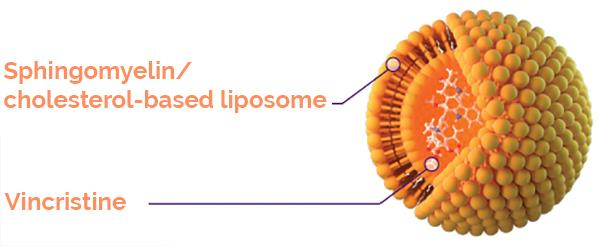
(1) Thuốc tiêm cấu trúc liposome chứa vincristin sulfat (Marqibo)
Bộ kít sản phẩm Marqibo gồm: 1 lọ chứa hoạt chất Vincristin sulfat (1 mg/ml, 5ml); 1 lọ chứa thành phần tạo liposome (Sphingomyelin/Cholesterol (103 mg/ml, 1 ml); 1 lọ chứa hệ đệm Sodium Phosphat (14,2 mg/ml, 25 ml). Thuốc được pha chế trước khi sử dụng để nạp dược chất (vincristin sulfat) vào liposome theo hướng dẫn của nhà sản xuất.
Cơ chế đưa thuốc đến mục tiêu của Marqibo
Vincristin sulfat được bao bọc trong cấu trúc liposome với thành phần là hỗn hợp Sphingomyelin/Cholesterol (60:40), thành phần của vỏ liposome có nguồn gốc tự nhiên và không gây độc tính. Cấu trúc liposome này cho tính độ ổn định cao với tính thấm thấp, cho phép giải phóng chậm vincristin, giảm sự rò rỉ vincristin ra khỏi liposome vào tuần hoàn. Cấu trúc vincristin sulfat liposome như sau:
Liposome có kích thước 100nm, giúp hạn chế đáng kể sự bắt giữ của hệ RES, tạo thuận lợi cho liposome phân bố thụ động vào các mô ung thư có khe hở giữa các tế bào có kích thước từ 100 – 780nm, trong khi khe hở giữa các tế bào ở mô lành có kích thước từ 5-10nm.
Nghiên cứu về dược động học của Jeffrey A. Silverman và Steven R. Deitcher cho thấy nồng độ vincristin tại kẽ mô ung thư cao hơn khoảng 70 lần so với mô bình thường sau 1 giờ và duy trì ở mức cao sau 48 giờ tiêm Vincristin sulfat liposome.
Như vậy dạng liposome giúp duy trì thuốc lâu trong tuần hoàn, làm tăng sự tích lũy thuốc tại mô ung thư. Sau khi giải phóng khỏi dạng liposome, vincristin sulfat chuyển hóa và thải trừ tương tự như dạng tiêm vincristin không liposome. Marqibo giúp đưa thuốc đến mục tiêu tác động là các mô ung thư, hạn chế được sự phân bố đến các mô lành khác, nhờ đó giúp tăng khoảng trị liệu và không gây độc tính cấp tính khi dùng liều cao (liều thường dùng của vincristin thông thường là 0,4 -1,4 mg/m2, tối đa 2mg/m2 trong khi liều khuyến cáo ban đầu của Marqibo là 2,25 mg/m2). Mặc dù liều chỉ tăng hơn 0,25mg/m2 nhưng nồng độ vincristin của Marqibo tại mô ung thư lớn hơn rất nhiều lần so với dạng vincristin tiêm thông thường.
Nguồn:
- J.A. Silverman và S. R. Deitcher (2013),"Marqibo® (vincristine sulfate liposome injection) improves the pharmacokinetics and pharmacodynamics of vincristine", Cancer Chemother Pharmacol. 71(3), tr. 555-64.
-Inc. Talon Therapeutics(2020),Full Prescribing Information forMARQIBO
(vinCRIStine sulfate LIPOSOME injection)
(2) Thuốc tiêm nano paclitaxel sử dụng hệ mang dạng tiểu phân nano
Thuốc tiêm nano paclitaxel là hệ có cấu trúc hỗn dịch với tiểu phân nano kích thước trung bình khoảng 130 nm, mang hoạt chất paclitaxel gắn kết với albumin.
Hệ thống đưa phần lớn thuốc đến mục tiêu nhờ sử dụng một công nghệ nano liên kết dược chất với albumin và đặc tính của mô ung thư.
Ưu điểm so với thuốc dạng dung dịch thông thường
Paclitaxel hầu như không tan trong nước, để khắc phục độ hòa tan trong nước kém, các dung môi dựa trên lipid được sử dụng để bào chế dung dịch đậm đặc pha tiêm chứa paclitaxel. Điều này có thể liên quan đến các độc tính nghiêm trọng và liều lượng. Thời gian tiêm truyền thuốc của paclitaxel dường như cũng ảnh hưởng đến hiệu quả lâm sàng của nó, việc truyền thuốc lâu hơn sẽ tạo ra hiệu quả lâm sàng lớn hơn, điều đó có nghĩa là tăng độc tính của nó hơn.
Hệ thống đưa thuốc đến mục tiêu nhờ liên kết dược chất với albumin có những ưu điểm so với các thuốc chứa paclitaxel đơn thuần hoặc dạng kết hợp với dung môi:
- Độ hòa tan trong nước của paclitaxel tăng lên đáng kể khi nó được liên hợp với đại phân tử hòa tan trong nước là albumin.
- Kích thước tiểu phân trung bình130 nm, cho phép tiểu phân được phân phối ưu tiên vào vị trí khối u do tính thẩm thấu và lưu giữ cao hơn, khe hở giữa các tế bào có kích thước từ 100 – 780nm.
- Chất mang thuốc là albumin tự nhiên trong cơ thể, giúp thoát khỏi sự nhận biết miễn dịch của hệ thống đại thực bào RES.
- Bên trong tế bào khối u, một protein đặc hiệu cho khối u được gọi là SPARC liên kết với thuốc. SPARC thường cung cấp các chất dinh dưỡng cần thiết cho các tế bào khối u. Do đó, việc liên kết với hệ thống cản trở việc cung cấp các chất dinh dưỡng trong khi được phân phối hiệu quả đến các tế bào đích.
- Paclitaxel được biến đổi với một albumin protein tự nhiên và do đó ít bị phản ứng quá mẫn cảm. Điều này giúp loại bỏ sự cần thiết của các loại thuốc như thuốc kháng histamine và steroid trước lịch trình để ngăn ngừa sự xuất hiện của quá mẫn.
- Trong thử nghiệm lâm sàng giai đoạn III được báo cáo, hệ mang paclitaxel với albumin (Abraxane®) có tỷ lệ đáp ứng điều trị gần như cao hơn gấp đôi (33% so với 19%), đáp ứng điều trị khối u ở mức độ cao hơn (42% so với 27%) so với dạng dung dịch paclitaxel thông thường (Taxol®)
Nguồn: -USFDA, Abraxane – Prescribing Information, trang 1-24
-Ping Ma and Russell J. Mumper (2013), “Paclitaxel Nano-Delivery Systems:
A Comprehensive Review”, J Nanomed Nanotechnol, trang 1, 7
GSTS. Lê Quan Nghiệm